말기 신장 질환 치료의 미래: 이식형 생체인공 신장 과제
의학과, 신장학-투석-신장 이식 부서, University of Padua, 35128 Padua, Italy심흉부 혈관 과학 및 공중 보건학과, 생물 통계학, 전염병학 및 공중 보건 부서, University of Padova, 35128 Padova, ItalyASL VCO, 28922 Verbania , 이탈리아외과 종양학과 위장병학과, 신장 및 췌장 이식 부서, University of Padua, 35128 Padua, Italy
신청 과학.2024, 14(2), 491;https://doi.org/10.3390/app1402049
추상적인
제한된 장기 가용성과 이식 후 합병증에도 불구하고 신장 이식은 말기 신장 질환(ESKD)에 대한 최적의 치료법으로 남아 있습니다. 그러나 이러한 문제를 해결하고 환자 치료를 개선하기 위해 휴대용, 착용형, 이식형 생체인공신장 시스템과 같은 혁신적인 투석 기술이 개발되고 있습니다. 이상적인 이식형 장치는 생물반응기와 혈액 한외여과를 결합하여 용질 재흡수, 분비 및 내분비학적 활동을 위한 주요 기본 세포 기능을 복제할 수 있습니다. 오늘날, 신장 세포 치료를 위한 이식형 생물반응기의 타당성은 면역학적 분리, 세포 생존 가능성 및 대사 활동을 위한 혈액 기질 유지 가능성을 보장하기 위해 실리콘 나노기공 막을 기반으로 하는 완전히 이식 가능한 생체 인공 신장을 개발해야 하는 과제를 열어줍니다. 현재 기술은 생리학적 혈액 정화에 도달하기 위한 효율적인 인공 생물반응기를 얻기에는 충분하지 않습니다. 이는 세포에 의해 처리되고 소변으로 제거될 수 있는 혈액에서 한외여과액을 생성하기 위해 더 복잡한 시스템이 필요합니다. 생물반응기의 세포 수, 내분비 활동, 면역학적 세포 분리, 용질 및 체액 분비/재흡수, 세포 생존율, 혈액 및 한외여과 흐름 제어, 혈전 형성은 오늘날의 도전 과제로 보이는 새로운 기술이 필요한 근본적인 문제입니다. 이식 가능한 인공 신장의 설계. 이 검토의 목적은 신장 대체 요법의 특정 분야의 최신 기술을 분석하여 모든 기본 신장 기능을 복제할 수 있는 인공 장기로 ESKD를 치료할 수 있는 이식 및 착용형 장기를 만들기 위한 현재의 한계와 가능한 미래 기술 개발을 강조하는 것입니다.
키워드:
말기 신장 질환;만성 신장 질환;신장 이식;이식 가능한 생체인공신장;생물반응기
- 소개
말기 신장 질환(ESKD)은 만성 신장 질환의 되돌릴 수 없는 마지막 단계를 나타내며, 심각하고 영구적인 손상으로 인해 신장이 필수적인 생명 유지 기능을 유지하는 능력을 상실합니다. 이 단계에서는 신장 대체 요법이 생존에 필수적입니다. 주요 치료 방법에는 투석과 신장 이식이 포함됩니다. 혈액투석 또는 복막투석으로 수행될 수 있는 투석은 신장이 더 이상 이러한 작업을 수행할 수 없을 때 혈액에서 노폐물과 과도한 체액을 기계적으로 제거하는 것과 관련됩니다. 혈액투석은 일반적으로 일주일에 여러 번(보통 일주일에 3회) 병원에서 시행되는 반면, 복막투석은 집에서 시행할 수 있지만 매일 치료가 필요합니다. 반면, 신장 이식은 신장 기능을 생존 또는 사망한 기증자의 건강한 신장으로 수술적으로 대체하는 것입니다. 이식은 일반적으로 투석에 비해 삶의 질과 생존율이 더 높지만 장기 거부반응을 예방하려면 면역억제제가 필요합니다. 이러한 각 치료법에는 적응증, 장점 및 한계가 있으며, 치료법 선택은 ESKD의 근본 원인, 환자의 전반적인 건강, 생활 방식 고려 사항 및 개인적 선호도를 포함한 환자별 요인에 따라 개별화됩니다. 이 기사에서는 착용형 및 이식형 인공 장기를 사용하여 신장 기능을 대체하는 기존 기술의 현재 한계와 향후 개발 가능성을 분석하여 최신 기술을 검토합니다.
1.1. 말기 신장 질환과 신장 대체 요법의 역사
인공 신장으로 인해 구제된 말기 신장 질환(ESKD) 환자의 총 수는 거의 추산할 수 없지만 확실히 매우 높습니다. 투석 기술 발전의 역사는 반투막 역할을 하는 2m 수평 드럼을 감싸고 있는 20m 길이의 회전 셀로판 튜브로 구성된 최초의 실용적인 투석기가 네덜란드 의사인 Willem Kolff 박사에 의해 실현된 1943년에 획기적인 사건 중 하나입니다. [1]. 필요한 큰 체외 부피를 고려하지 않은 이 장치의 주요 한계는 체액 제거가 부적절하다는 점이었습니다. 이는 수액 초과 시 가장 중요한 문제 중 하나입니다
신장 기능 장애에 부담을 줍니다. 실제로 이 시스템에서 중력은 환자의 임상 상태에 따라 한외여과를 효과적으로 달성하는 데 적합하지 않은 막횡단 압력을 생성합니다. 따라서 폐부종이나 고혈압과 같은 체액 과부하가 특징인 상태는 이 장치로 효과적으로 치료할 수 없습니다.
이 프로토타입의 개봉 성공 이후 체액 제거를 보장하기 위해 더 높은 막횡단 압력을 견딜 수 있는 수정된 투석기가 구현되었습니다[2]. 스케일과 흐름 제어를 사용하는 정밀한 한외여과 제어 시스템의 후속 개발로 체액 제거가 정확하고 안전하게 이루어졌으며 체액 균형 제어는 각 개별 임상 설정에 대해 달성 가능하고 사용자 정의 가능한 임상 목표가 되었습니다. 1960년 시애틀에 최초의 만성 투석 시설이 설립되면서 신부전은 더 이상 치명적인 질병이 아니었습니다.
1.2. 한계와 새로운 관점 사이의 현재 체외 정화
현재의 혈액투석 기술에는 원래의 거대 회전 드럼 신장을 대체한 중공 섬유 투석기가 포함되며 오늘날 급성 신장 손상(AKI) 또는 ESKD로 병원에 입원한 환자에게 필수적인 치료 옵션을 나타냅니다. 이러한 장치가 환자의 생명을 연장시키는 것으로 나타났지만, 기존의 혈액 정화 기술은 환자의 혈액에서 분자를 제거하는 과정에만 기반을 두고 있어 아직 완벽하지 않습니다.
환자의 삶의 질, 혈액내 투석 문제, 여전히 타의 추종을 불허하는 신장 대사 기능 대체 등의 단점을 극복하려면 새로운 기술이 필요합니다. 현재 이용 가능한 혈액 정화 시스템은 효율성, 효율성, 생체적합성 측면에서 개선됐지만 혈액 정화의 원리는 1세대 인공신장과 변함이 없다. 이러한 관점에서 투석기의 주요 목표는 투석 필터보다 더 복잡한 시스템으로 수행할 수 있는 활성 기능인 분자 재흡수, 이화 작용 및 내분비 기능을 제공하지 않고 환자로부터 용질 제거 및 체액 제거입니다. 생명공학은 특정 투석기 구조, 성능, 생체 적합성 및 막 재료를 기반으로 ESKD 동안 잔류하는 분자를 제거하기 위한 특정 혈액 정화 기술을 개발했습니다. 따라서 이 분야의 연구는 표적 분자를 제거하는 데 점점 더 효율적이기는 하지만 특정 분자의 재흡수 및 분비 분야에서는 실행 가능한 솔루션을 찾지 못하는 장치를 찾는 방향으로 진행됩니다. 혈액정화를 위한 인공신장과 반투막은 여전히 연구과제이다. 인공 신장은 미래의 생체 인공적 특성으로 인해 분비, 재흡수, 대사 활동 등의 활동을 도입하여 체외 정화 기능을 크게 구현할 수 있습니다. 합성막, 나노기술 및 투석 경험의 발전은 향후 투석기 개발의 잠재력에 기여했습니다. 실제로 현재 사용되고 있는 혈액 정화 시스템을 개발하는 데는 수십 년이 걸렸습니다. 요즘 이러한 개발로 인해 ESKD에 대한 정기 투석에서 중환자실(ICU)의 지속적인 신장 대체 요법(CKRT)으로 전환할 수 있게 되었습니다. CKRT를 수행하기 위한 고급의 안전한 소프트웨어 및 하드웨어를 보유할 수 있는 능력을 통해 특히 임상적 요구에 맞게 신장 대사 보상을 지속적으로 조정해야 하는 매우 위독하고 불안정한 환자의 경우 지속적으로 신장 기능을 대체할 수 있습니다. 이러한 기술적 구현에도 불구하고, 현재 혈액투석 기술의 세 가지 주요 단점인 환자의 삶의 질, 투석 치료 중 발생할 수 있는 기술적 문제, 신장의 대사 대체 불가능성을 개선하기 위한 많은 연구가 여전히 진행되고 있습니다. 기능 [3].
차세대 인공장기 개발을 이끌어야 할 가장 중요한 점은 자연 신장이 단순한 여과 기관이 아니라는 점이다. 실제로 이들은 1,25-디하이드록시비타민 D(1,25(OH)2 D)[4], 암모니아 생성[5,6], 글루타티온의 합성과 같은 여러 대사 기능도 담당합니다. 신진 대사 [7], 에리스로포이에틴 생산 [8] 및 면역 조절 지원 [9]. 따라서 모든 신장 기능을 실제로 수행하려면 신장 대사 역할을 고려해야 합니다. 사실, 현대 인공 신장 디자인은 투석과 체액 제거의 효율성에 중점을 두지만 대사 기능에는 중점을 두지 않습니다. 임상적인 관점에서 이러한 대사 활동의 부족은 혈액 검사를 통해 정기적으로 확인해야 하는 생화학적 피드백에 따라 환자에게 투여되어야 하는 특정 약물의 사용을 필요로 합니다. 따라서 치료 조정은 메타의 경우처럼 지속적인 온라인 피드백을 받을 수 없기 때문에 지속적으로 지연될 수 있습니다.
자연 신장의 대사 활동. 전형적인 예로는 환자의 헤모글로빈을 일정하게 유지하기 위해 에리스로피에틴 투여 용량과 빈도를 변경하거나 적절한 골 대사를 유지하기 위해 비타민 D 유사체를 투여하는 것입니다. 현재 장기 기능을 대체하는 가장 효과적인 접근법은 이식된 장기를 활용하는 것입니다. 제한된 장기 가용성과 이식 후 합병증 가능성에도 불구하고 신장 이식은 ESKD에 대한 최적의 치료법으로 남아 있습니다. 반면, 체외 투석과 복막 투석은 생명 유지에만 도움이 되며 요독 독소를 제한적으로 제거합니다. 기술의 발전에도 불구하고 혈액투석(HD)은 여전히 비용이 많이 들고, 사망률이 높고, 혈관 접근 합병증이 높으며, 복막투석에 비해 삶의 질과 환자 만족도가 낮지만, 효능이 낮고 감염 위험도 높습니다. 이것이 HD로 전송하는 주된 이유입니다[10]. 가정 혈액투석(HHD)은 병원 내 혈액투석보다 생리학적으로 더 좋고 환자가 더 잘 견딜 수 있는 것으로 알려져 있습니다. 또한, 센터 내 혈액투석에 비해 향상된 생존율과 삶의 질(QOL), 유연성, 취업 가능성 등 여러 가지 장점을 가지고 있습니다[11,12,13,14]. 기술 연구는 기본 신장의 한외여과 및 분비의 활성 과정을 모방하는 새로운 투석기와 같은 새로운 정화 장치의 개발을 통해 표준 HD의 제약을 극복하기 위해 가정 혈액 투석 서비스의 개선 및 소형화 방향으로 나아갔습니다[15]. 투석액 재생을 위한 멤브레인, 웨어러블 기술 및 흡착제. 이러한 발전은 자연적인 신장 기능을 완전히 대체할 수 있는 이식 장치 개발을 향한 첫 번째 단계를 나타냅니다.
혈액투석기의 소형화에는 혈관 접근, 순환계의 혈류, 정제 기술, 이화작용 및 합성 활동과 같은 다양한 임상적, 기술적 요소를 포함하는 다학문적 노력이 필요한 첨단 기술의 개발이 필요합니다. 혈액투석 치료에 최소 120L의 투석액이 필요하다는 점을 고려하면, 시스템을 휴대용 장치로 소형화하기 위해서는 폐액의 재생이 필요하다. 목표는 화학적 분해와 이온 교환[16,17] 또는 흡착을 통해 물질을 제거하여 전해질 농도를 정상 범위 내로 유지하는 것입니다. 일반적으로 장기간 치료, 특히 CKRT는 인산염과 칼륨의 경우처럼 외부 보충이 필요한 이온을 과도하게 제거하는 결과를 임상적으로 초래할 수 있습니다. 이는 간호사의 업무 과중과 처방, 사용되는 수액 유형, 처방된 정화 용량 측면에서 치료 맞춤화의 필요성이 반영됩니다. 웨어러블/이식형 기기에서 이 문제는 의사, 간호사, 환자의 외부 개입을 최소화하는 데 사용되는 기기의 내재적 솔루션으로 해결되어야 합니다. 특정 장치는 투석액에서 물질을 제거하는 것뿐만 아니라 이온을 교환하는 데에도 중요한 역할을 할 수 있습니다. 이러한 목적으로 가장 일반적으로 고려되는 흡착제는 활성탄입니다. 역사적으로 활성탄은 6L 배치의 투석액을 재순환시키는 가정용 투석 시스템에 사용되었습니다. 현재, 혈액투석과 복막투석 모두에 대한 투석액 요구량을 줄이기 위해 활성탄(AC)을 이용한 폐투석액 처리가 고려되고 있습니다. 그러나 다른 유기 폐기물 화합물과 달리 흡착제에 잘 결합하지 않는 다양한 요독성 용질[18], 특히 요소를 제거하는 활성탄의 능력에 대한 연구는 거의 없습니다(AC에 대한 친화도 ~0.1mmol/g). . 또한 그 양은 240~470mmol/일 범위로 일관되어 대사의 주요 질소 폐기물이 됩니다[19]. 환자의 개별 대사 요구에 맞게 정화 용량을 맞춤화해야 하는 필요성은 중요한 역할을 하며 새로운 이식형 장치에 대한 과제를 나타냅니다. 웨어러블 소형화 장치에 적용 가능한 기술에 따르면, 요소분해효소 촉매 가수분해를 사용하여 요소보다 독성이 강한 중탄산염과 암모늄으로 요소를 제거할 수 있습니다. 이 경우, 투석액에 의한 암모늄을 제거하기 위해 인산지르코늄을 사용할 수 있으며; 대신 가수분해에 의해 방출된 중탄산염은 양성자와 반응하여 물과 이산화탄소를 생성하고 투석액 폐쇄 루프 시스템에서 효과적으로 제거됩니다[20]. 재사용 가능한 흑연 전극이 있는 장치를 사용하여 투석액에서 가스를 배출할 수 있는 N2 및 CO2로의 전기화학적 분해를 활용하여 16mmol/h의 속도로 요소를 제거하는 것도 가능합니다[21]. 카트리지 흡수는 효과적이고 간단하며 안전한 방법으로 요소를 제거하는 또 다른 솔루션이 될 수 있습니다. 흡착제는 공유 결합 또는 배위 결합(화학 흡착)을 형성하여 투석액에서 요소를 제거할 수 있습니다.
또는 비공유 결합(반데르발스 힘, 쌍극자 상호작용 및 수소 결합, 즉 물리흡수)에 의해 발생합니다. 그러나 물리흡착에서는 과정이 더 빠르더라도 투석액에 용해된 요소와 평형을 이루는 흡착제에 결합된 요소로 인해 결과적인 결합이 약해져 제거 효율이 낮아집니다. 최근 개발을 통해 투석액에서 요소를 효과적으로 제거하기 위한 흡착제의 잠재력이 나타났습니다. 그 중에는 이산화규소(실리카)와 제올라이트가 있습니다. 그러나 제올라이트에서 알루미늄 침출은 환자에게 잠재적인 위험을 초래할 수 있습니다. 이러한 모든 솔루션은 기술적 관점에서 매우 흥미롭고 매력적이지만 가까운 미래에 이식되고 불굴의 정화 시스템으로 발전할 가능성이 없는 프로토타입에서 엄격하게 실험적으로 사용하도록 하는 일련의 제한 사항을 여전히 제기하고 있습니다. 인공 신장(WAK)은 환자의 요구에 대한 실용적인 솔루션을 제공하는 매우 유망한 방법이 될 수 있습니다. 그러나 현재 임상 실습에 사용되는 WAK 시스템의 구현을 시도하고 달성하려는 기술 제안은 몇 가지에 불과합니다 [15]. Guraet al. 착용 가능한 인공 신장을 사용한 치료는 내약성이 우수하여 효과적인 요독 용질 제거로 전해질 및 체액 항상성이 유지된다는 것을 입증했습니다. 그러나 등록된 7명의 피험자 중 5명만이 계획된 24시간 치료 연구를 완료했습니다. 실제로 투석액 회로 내 과도한 이산화탄소 기포 등 장치 관련 기술적 문제로 인해 시험이 중단됐다. 웨어러블 기기의 체외 정화에 가장 중요한 요소 중 하나는 장기간 투석액을 재생하는 능력입니다. 흡착제 기반 투석액 재생 시스템은 수년 동안 급성 및 만성 신부전 환자의 치료에 효과적으로 적용되어 왔으며 현재 이 연구 분야에서 큰 잠재력을 가지고 있는 것으로 보입니다. 그러나 투석액의 pH와 전해질 조성을 환자의 임상 상태에 필요한 범위로 유지하기 위해 흡착제와 수지를 사용하는 것과 관련된 문제가 있습니다. 예비 보고서에서 Gura et al. [16]은 한외여과를 통해 혈압에 큰 변화 없이 약 1L의 물이 제거되었기 때문에 환자가 이 치료를 매우 잘 견디고 먹고 마시는 것이 허용되었음을 입증했습니다. 더욱이, 그들은 투석간 증상이 없고 치료 후 회복 시간이 최소 또는 0이라는 측면에서 환자 피드백을 입증했습니다. 환자들은 치료 유연성, 자유도 및 생활 방식 개선 측면에서 이 장치의 치료 잠재력에 대해 똑같이 긍정적인 인식을 보였습니다. 이러한 기술의 임상적 주관적 영향은 시스템이 안전하고 일상 생활에서 사용하기 쉽다는 환자의 인식과 함께 긍정적인 것으로 보입니다. 이러한 발견은 확인된 기술적 문제를 해결하기 위해 재설계함으로써 전통적인 투석 기술에 대한 혁신적이고 실행 가능한 대안으로 착용 가능한 인공 신장을 성공적으로 만들 수 있음을 확인합니다. 이상적인 이식 가능한 생체 인공 신장은 전체 신장 기능을 모방함으로써 투석액 재생 문제를 극복할 수 있습니다. 이는 용질 재흡수, 분비 및 내분비학적 활동(1,25-OH-비타민 D 및 에리스로포이에틴 생산)을 위한 주요 기본 세포 기능을 복제하기 위해 생물반응기와 혈액 한외여과를 결합함으로써 달성될 수 있습니다. 복잡한 신장 기능을 모방하고 여과 및 분비를 통해 체액 균형과 노폐물 제거[23]를 달성하기 위해 이식형 생물반응기는 한외여과 시스템과 결합되어야 합니다. 이는 중탄산염, 아미노산, 포도당 및 인산염과 같은 유용한 분자의 재흡수를 보장합니다.
신장학, 특히 체외 혈액 정화 분야에서 생물반응기는 생리학적 신장 기능을 모방하기 위해 통제된 환경에서 신장 세포 또는 조직의 성장, 유지 및 기능을 지원하도록 설계된 특수 장치로 정의될 수 있습니다. 대사 및 분자 재흡수 및 분비 활동을 통한 투석 기술 개발을 향상시키기 위한 혈액 정화 플랫폼을 제공합니다.
간단히 말해서, 인공 신장의 미래는 가능한 모든 기술을 결합한 소형화 및 이식성, 더 나은 생체 적합성 및 대사 기능을 목표로 합니다. 멤브레인이 체외 치료의 핵심이라는 점은 의심할 여지가 없으며, 멤브레인 설계, 화학적 구성 및 멸균 방법의 기술 발전으로 인해 투석의 “비생리적” 감소로 성능이 향상되었습니다. HD 멤브레인의 구성을 변경하면 생체 적합성이 향상되고 환자의 삶의 질이 향상되었습니다. 특히, 고분자 또는 무기 물질로 구성된 막은 합성 막에 비해 요독 독소 제거에 더 효율적인 것으로 보입니다. 그러나 혈액투석에 사용되는 막은 효율적입니다.
작은 수용성 용질과 독소를 제거하는 데 효과적이지만 중대형 분자와 독소에 대해서는 효율성이 비례적으로 감소합니다. 단백질 결합 요독 독소도 제거하기 어렵습니다. 이상적으로, 막은 최대 66 kDa의 분자량을 차단하여 사구체 여과를 모방해야 합니다[24]. 지속적인 신장 여과를 모방하면서 이러한 멤브레인을 장기간 사용하면 생체 적합성 및 필터 개통성과 같은 문제가 발생하여 이식형 장치 개발에 대한 추가 과제가 됩니다. 생물학적 기능과 정화 효능을 구현하기 위해 새로운 막은 생물인공 신장과 결합될 수 있으며, 여기서 인공 막은 생물 반응기에서 신장 세포와 결합됩니다. 현재 인공 신장 장치의 단점을 극복하기 위해 실리콘 나노기공 막, 신장 세포 생물 반응기의 조직 공학 및 투석액 재생에 대한 연구 및 시험이 개발 중입니다. 미래의 발전을 통해 착용 가능하거나 이식 가능한 인공 신장이 곧 달성될 것입니다[26]. 신장 세포 치료를 위한 이식형 생물반응기의 타당성은 Kim et al.에 의해 입증되었습니다. [27], 완전히 이식 가능한 생체인공신장(iBAK) 개발에 대한 도전을 열었습니다. 이러한 장치는 면역학적 분리, 세포 생존 가능성 및 대사 활동을 위한 혈액 기질 유지 가능성을 보장하는 실리콘 나노기공 막을 기반으로 합니다.
멤브레인 분야 연구에서는 기존 투석기의 실제 구조적 한계로 인해 웨어러블 및 이식형 기기에서 혈액 정화의 한계를 극복하기 위한 새로운 소재를 개발하고 있습니다. 새로운 합성 투석막은 생체적합성을 향상시키기 위해 폴리비닐피롤리돈(PVP) 또는 기타 첨가제와 혼합된 소수성 폴리머로 구성되지만, 장기간 사용 및 멸균 과정에서 용출되어 호환성이 감소할 수 있습니다[28,29]. 이 문제를 해결하기 위해 폴리비닐리덴 불화물 멤브레인을 폴리비닐알코올과 키토산으로 코팅합니다. 이는 생체적합성을 향상시키고[30] 백혈구, 보체 활성화 및 필터 응고를 결정할 수 있습니다. 필터 응고 문제는 폴리설폰 막 표면에 아르가트로반을 접목한 막을 사용하여 감소시킬 수 있으며[31], 우수한 항혈전 효과를 얻습니다. 이러한 모든 구현에도 불구하고 이 새로운 유형의 멤브레인의 잠재적인 소형화는 섬유 기하학적 구조 및 수력 저항으로 인한 투과성 제한으로 인해 제한되며 이는 부피가 큰 장치가 필요합니다. 또 다른 막의 한계는 여과 선택성을 제한하는 상대적으로 넓은 기공 크기 분포인데, 이는 이제 기공 크기 간의 편차가 1% 미만인 균일한 나노기공을 제공하는 실리콘 기반 나노다공성 막(SNM)에 의해 극복되었습니다[32,33,34]. 낮은 다공성으로 인해 투과성을 향상시키기 위해 이러한 SNM은 나노슬릿(폭 10nm, 길이 4.5μm) 배열로 제작되었으며[34], 혈액투석 및 혈액여과에 적합한 균일한 나노기공을 제공합니다. 임상 사용에서의 한계는 대식세포의 활성화, 선천성 면역 조절 장애 및 염증을 방지하기 위해 폴리에틸렌 글리콜(PEG)로 친수성 코팅이 필요한 열악한 실리콘 혈액 적합성과 관련됩니다. 이식 가능한 인공 신장의 경우 PEG가 빠르게 분해될 수 있으므로 이 기술 솔루션은 확실하지 않습니다[34]. 따라서 훨씬 더 오래 지속되는 대안이 필요합니다. 폴리에테르설폰/폴리비닐피롤리돈(PES/PVP)을 기반으로 하는 혈액적합성 내부 다공성 층과 투석액과 접촉하는 PES/PVP 매트릭스 내에 분산된 활성탄의 외부 층의 조합은 향상된 혈액적합성과 관련된 낮은 세포 접착력을 결정할 수 있습니다. 확산/대류에 의한 독소 제거 및 활성탄 입자에 의한 내부 막층 흡착. 이는 막을 가로질러 높은 독소 농도 구배를 유도하여 혈장 단백질로부터 단백질 결합 독소의 추가 해리를 자극합니다. 이 공정을 통해 기존 혈액투석막보다 더 적은 양의 투석액을 적용할 수 있습니다. 또한, 이 막 구조는 투석액으로 인한 세균성 발열원 오염으로부터 환자를 보호할 수 있습니다[35]. 그러한 막의 개발은 장기간 적용을 위해 적은 양의 투석액이 필요한 이식형 시스템에 중요한 이점을 제공하는 것으로 보입니다. 이러한 이식 장치를 장기간 동안 사용하면 박테리아 오염을 비롯한 투석액 특성이 저하될 수 있으므로 모든 형태의 환자 보호가 도움이 될 수 있습니다. 사구체 여과를 모방하기 위해 현재 막의 특성을 WAK에서 구현해야 했으며 시스템에는 폐쇄 루프 투석액 재생 시스템이 제공되어야 했습니다. 그렇지 않으면 여과액에서 물, 이온, 포도당 및 아미노산의 관형 재흡수를 모방하기 위해 다음을 기반으로 하는 특정 기술을 암시할 필요가 있습니다.
n 이온 교환 수지 조합, 이온 교환막 및 외부에서 인가되는 전압을 통해 선택적 이온 재흡수를 달성합니다.
1.3. 인공 신장용 생물반응기
생물반응기는 미래에 현재 투석 필터에 의해 결정되는 여과 및 흡수 활동에 대한 대사 지원을 제공할 수 있습니다. 결합된 혈장 정수 시스템과 한외여과액 및 혈액 재처리 장치는 혈액 정화를 위한 보다 복잡한 장치의 기초입니다(그림 1). 이식형 생체인공신장(iBAK)의 인공막에 배양된 근위 세포를 사용하는 것은 근위 세뇨관 기능을 모방하는 것을 목표로 합니다. 그러나 셀 소스 가용성, 배포, 저장 및 후속 재구성은 문제를 나타냅니다. 성체 전구 신장 세포의 신장 상피 세포로 덮인 니오븀 코팅 탄소 디스크에 실험적 생체 인공 신장 상피 세포 시스템을 설계할 수 있는 기회는 이 장치를 최종 사용 위치에서 휴대하고 해동할 수 있도록 냉동 보존 및 냉동 보관할 수 있는 가능성을 보여줍니다. [36]. 기능화된 중공 섬유의 불멸 근위 세뇨관 상피 세포와 기존 혈액 투석 필터의 조합으로 이 기술을 사용하면 사구체 여과, 세뇨관 분비 및 재흡수를 모방할 수 있어 가장 “생리적”이고 신장 기능을 완전히 대체할 수 있습니다[37,38]. 이러한 기술의 가용성을 통해 SNM으로 배양된 돼지 신장 세포(LL-CPK1) 생물반응기 장치와 직렬로 연결된 10 nm 미만의 폭의 슬릿 기공을 가진 SNM 혈액 필터로 구성된 동물 iBAK 프로토타입의 실현이 가능해졌습니다.
그림 1. iBAK 및 네프론, 네프론 활동을 모듈식 및 복잡한 장치에 통합합니다. 빨간색은 혈액이 장치에 들어가는 것입니다. 파란색은 혈액이 장치에서 빠져나가는 것입니다. 노란색은 필터와 생물반응기에 의해 처리된 투석액과 한외여과액입니다. 여과, 한외여과액으로부터의 재흡수, 한외여과액으로의 분비, 투석액의 재생, 호르몬 생성, 수분 재흡수/배설 조절 등의 기능은 보다 복잡한 장치의 생물반응기와 결합된 다양한 장치에 의해 처리됩니다.
현재 iBAK의 향후 개발과 관련된 임상 결과가 있는 유일한 장치는 Gura가 설계한 WAK인 것으로 보입니다[16,39]. WAK는 각각 더 짧은(최대 8시간) 및 더 긴(24시간) 두 가지 혈액투석 기간 요법에 대한 세 가지 소규모 임상 시험에서만 테스트되었습니다. 요소, 크레아티닌, 인의 한외여과와 제거가 효과적인 것으로 밝혀졌습니다. 이 시스템의 주요 중요성은 확산 방식에서 효과적이고 임상적으로 관련된 중간 분자 제거를 달성하기 위한 기포 형성, 필터 및 라인의 응고, 지속적인 치료의 필요성과 관련이 있습니다. 확산과 대류의 결합은 정화 효율을 높일 수 있지만, 착용형 및 이식형 장치에서는 투석액의 양이 적고 한외여과액을 재생할 수 없다는 점으로 인해 제한됩니다. 이 문제는 투석기를 가로질러 앞뒤로 소량의 투석액으로 교대 막횡단 압력을 생성하여 중간 분자 제거율을 향상시키는 대류력을 생성하는 프로세스인 “푸시-풀” 펌프를 구현함으로써 부분적으로 극복될 수 있습니다. 이 시스템을 마이크로 밸브와 표준 실리콘 및 마이크로 전자공학 기술과 통합하면 유체 채널과 유체 펌핑을 열고 닫을 수 있어 웨어러블 장치에 사용할 수 있게 됩니다[40].
- 현재의 기술적 한계를 뛰어넘는 미래관점
현재 기술은 개별적인 기술적 문제를 극복하기 위해 개발되었지만[41] 현대 장치가 모든 신장 기능을 모방할 수 없기 때문에 인공 신장 개발에 실제 통합으로 이어지지는 않았음이 분명합니다. 지금까지 얻은 실험 결과는 임상 시험에 사용할 프로토타입 설계의 미래를 열어주었습니다. 개별적으로 이러한 실험적 성과는 생리학적 혈액 정화에 도달할 수 있는 효율적인 인공 생물반응기를 얻기에는 충분하지 않습니다. 이 목표를 달성하려면 새로운 유형의 이식 가능한 iBAK가 필요합니다. iBAK는 세포에 의해 처리되고 장루나 방광을 통해 “인공 소변”으로 제거될 혈액의 초여과액을 제공할 수 있는 보다 복잡한 시스템에 삽입될 수 있습니다. 동시에, 혈액과 생물반응기 사이의 접촉은 신장 세포에 영양 기질을 제공하고 내분비 활동을 보장할 수 있어야 합니다(그림 1). 실리콘 나노기공 막의 사용은 미래의 iBAK 실현에 매우 유망해 보이지만[27], 일부 기술적 측면에서는 사용이 제한되는 것으로 보입니다. 생물반응기의 신장 세포 수(1.2 × 107개 세포 대 인간 신장의 5 × 109개 근위 세뇨관 세포)[42]는 생리적 네프론 질량과 비교하여 생리적 용질 분비, 재흡수 및 호르몬을 보장하기에는 너무 적습니다. 생산
. 세포 수가 증가하면 면역학적 격리가 더 이상 효과적이지 않아 세포가 손상되거나 사망할 수 있습니다. 세포 생존 가능성은 시간에 따라 제한될 수 있으며, 이는 생물반응기에서 세포 교체 빈도가 더 빨라지는 문제를 분명히 야기하며, 이는 기능이 수개월 동안 지속되어야 하는 이식형 장치에 적합하지 않습니다. 또 다른 핵심 포인트는 혈류 조절과 체액 제거를 위한 한외여과 조절입니다. 실제로, iBAK의 혈류는 지속적인 생물반응기 관류를 보장하고 지속적인 인공 소변 생산을 위해 안정적인 유체 한외여과를 유지하기 위해 안전한 흐름-압력 피드백을 갖춘 동정맥 구배를 기반으로 해야 합니다. 이러한 제어 메커니즘은 또한 환자의 혈액량 상태를 유지하기 위해 환자의 적혈구 용적률과 혈액 단백질 수준에 의존해야 하는 체액 제거 측면에서 공학적 과제를 요구합니다. 환자의 저혈량증이 있는 경우 인공 소변에서 체액을 재흡수하는 것은 주요 공학적 과제입니다. 이는 혈장 삼투압과 관련하여 나트륨과 물의 동시 재흡수 측면에서 물리적, 생화학적 복잡성 때문입니다[43]. 이 문제에는 한외여과[44], 혈류 및 체액 재흡수 또는 제거 관리를 위한 알고리즘을 포함하여 복잡한 피드백으로 혈장 삼투압을 조절할 수 있는 고급 기술의 사용이 필요합니다. 이러한 한외여과 메커니즘의 시너지 효과는 과다혈량증 및 급성 폐부종과 같은 합병증을 피하기 위해 올바른 체액 균형이 필수적인 무뇨증 환자에게 필수적입니다. 반면, 이뇨가 보존된 환자의 경우 탈수 상태를 피하기 위해 장치에 집중하는 능력이 필수적입니다. 중탄산염을 재생하고 수소 이온을 제거하는 생물반응기 능력의 부족은 산-염기 균형 유지에 영향을 미칠 수 있습니다. 마찬가지로, 알도스테론에 대한 피드백 부족은 칼륨 분비 및 나트륨 재흡수의 결핍을 나타낼 수 있는 반면, ADH 표적 세포의 부족은 혈장 삼투압에 임상적으로 유의미한 변화를 초래할 수 있습니다. 이러한 모든 활동은 단일 세포주를 포함하는 생물반응기를 통해 재현될 수 없으며 이러한 특정 기능을 위해 다양한 세포 유형이 필요합니다. 단일 생물반응기에서 여러 세포주를 집중시키는 것은 현재로서는 생각할 수 없는 일입니다. 이는 수행해야 하는 특정 기능에 따라 혈액과 한외여과액 사이의 상호 작용이 다르기 때문입니다. 추가적인 문제는 장치의 혈전성에서 발생하는데, 이는 혈액 접촉으로 인한 혈전성 효과를 최소화하기 위해 생체 적합성이 뛰어난 재료를 사용하여 극복할 수 있습니다. 더욱이, 이식성을 위한 소형화를 추구하는 과정에서 한외여과 장치의 기하학적 구조는 이상적인 한외여과 프로필을 위해 혈류의 적절하고 균일한 분포를 제공해야 합니다[45]. 이러한 구성을 통해 혈류를 극대화할 수 있으며, 최대한 소형화된 여과면에 비해 최고의 한외여과 성능을 얻어 이식성을 보장합니다. 웨어러블 한외여과 장치(WUF)와 WAK는 이미 인간을 대상으로 테스트되었으며[46] 고무적인 임상 결과를 얻었습니다. 그러나 기술적 한계로 인해 추가 개발이 방해를 받았습니다. 이러한 장벽은 중심정맥 카테터(CVC)에 의해 제공되는 혈관 접근, 전신 항응고의 필요성, 장치의 무게(1.1Kg), 착용 가능 및 이식 불가능 특성, 낮은 배터리 수명과 관련이 있습니다[47]. 위의 모든 제약은 나노기술, 재료물리학, 재료공학, 소형화 및 미세유체공학과 같은 새로운 학문의 활용을 통한 인공 신장 분야의 혁신으로 해결될 수 있으며[48], 새로운 투석 시대를 열 수 있습니다. 도전 과제는 궁극적으로 수백만 명의 생명을 구할 수 있는 iBAK의 개발입니다[49].
센터 내 혈액투석에서 가정 혈액투석으로 전환하는 기술적 과정에는 장치의 소형화와 착용성을 향한 진보적인 사용을 가능하게 하는 기술 혁신의 도입이 필요합니다. 혈액투석 요법은 제한된 범위의 요독 독소를 불연속적으로 제거하고 많은 양의 투석액을 필요로 하여 휴대성과 환자의 삶의 질 및 자율성을 제한하기 때문에 현재 기술은 제한적입니다. 해결해야 할 첫 번째 문제는 필요한 투석액의 양 감소와 웨어러블 및 이식 장치의 재생에 관한 것입니다. 이러한 목적으로 다양한 유형의 흡착제를 사용하면 흡착제 생산 및 재활용의 생태발자국에 영향을 미칩니다. 웨어러블/이식형 장치에서 투석액의 부피 감소로 인한 요독 독소 제거 감소는 새로운 투석막에 고분자 또는 무기 물질을 사용하여 보상됩니다. 이러한 혁신적인 멤브레인은 여과 및 흡착을 통해 광범위한 분자 제거를 향상시켜 높은 효율성과 낮은 레벨을 보장할 수 있습니다.
기존 혈액투석용 막과 비교하여 막 오염이 1s에 달합니다. 단순해 보이는 요독 독소 제거 기능은 적혈구생성인자 및 비타민 D 생성과 같은 신장의 모든 기능을 대체하는 생물학적 기능과 결합되어야 합니다. 호르몬뿐만 아니라 약물의 이화작용과 시스템에서 처리된 초여과액으로부터 유용한 분자의 재흡수도 가능합니다(그림 1). 이러한 방식으로 물리적 확산 및 대류 과정을 최대한 활용하여 정제 과정에서 유용한 분자의 손실을 초래하지 않고 환자의 대사 균형을 유지하는 정제 목표를 달성할 수 있습니다. 이 시나리오에서는 장치에 대한 유지 관리 개입을 줄이면서 장기간 대사 기능을 생존하고 유지할 수 있는 신장 세포를 사용하여 합성 대사 요구와 재흡수 과정을 보장해야 합니다. 가장 큰 문제는 신장세포의 공급원과 투석센터에 부착된 배양시설, 그리고 마지막으로 대규모의 저가이다. 이러한 시스템의 복잡성으로 인해 제조, 타당성 및 물류와 관련된 여러 가지 문제가 발생합니다. 복잡한 이식형 인공 신장은 체외 장치보다 혈류 저항이 훨씬 낮습니다. 자연 혈압을 원동력으로 사용하면 인공 혈액 펌프가 필요 없고 에너지 공급 요구 사항이 줄어듭니다. 이 구성은 장골 혈관을 연결하여 달성할 수 있지만 문합, 혈액 적합성 및 표면 혈전 형성은 이식 장치의 중요한 문제를 나타낼 수 있습니다. 이러한 문제를 극복하기 위해 장기적으로 안정성이 최적이 아니며 폴리에틸렌 글리콜을 사용한 대체 솔루션은 효과가 제한적임에도 불구하고 헤파린 코팅 표면을 사용할 수 있습니다. 확실히, 혈관 접근은 수개월/수년 동안 제자리에 유지되어야 하는 이식 장치의 핵심 주제가 됩니다. 이러한 혈관 접근은 연결된 장치의 쉽고 빠른 교체, 적절한 혈류 및 수반되는 급성 및 만성 질환으로 인한 상대 저혈압 또는 저혈량증 중에도 응고 위험 감소를 보장해야 합니다. 유망한 해결책은 설포베타인으로 실리콘 막을 코팅하는 것입니다[50]. 이식된 장치는 생리학적 용질 분비, 재흡수 및 호르몬 생성을 제공하기 위해 여과와 생물반응기의 신장 세포 수 증가 가능성을 보장하기 위해 크기와 막 표면 사이의 균형이 필요합니다. 이 장치를 침습적 수술로 이식하려면 환자가 지속적인 유지 관리 개입이나 수술에 의존하지 않도록 하기 위해 심실 보조 장치와 같은 제품 안전 수준과 고장과 수명 사이의 평균 시간이 필요합니다.
마지막으로, 신장 생리학의 복잡성으로 인해 복합 iBAK의 개발이 필요하며, 이는 모든 신장 기능을 인위적으로 재현하는 기술 개발을 위한 여러 분야의 협력의 결과여야 합니다. 복잡한 iBAK 도입 가능성은 모든 단일 신장 기능(한외여과, 호르몬 생산, 재흡수, 분자 분비, 신진대사, 체액 균형 등)을 대체하는 고유한 모듈식 장치의 개발을 가능하게 할 수 있습니다. 이러한 모듈의 통합 및 점진적인 소형화[51]를 통해 기능 통합보다는 개별 문제 해결에 초점을 맞춘 현재 치료 옵션보다 더 효과적으로 신장 기능을 대체할 수 있는 장치를 개발할 수 있습니다. 개별 유닛으로 구성된 모듈식 장치를 채택할 기회는 전체 장치 대신 단일 부품을 교체하거나 수리할 수 있게 하여 장치의 유지 관리를 더욱 효과적으로 할 수 있습니다. 따라서 인공 장기를 통한 신장 기능 대체를 보장하기 위한 미래의 실제 과제는 복합 iBAK 또는 오가노이드로부터 인공 이식 가능한 신장을 개발하는 것입니다[52,53].표 1은 iBAK에서 사용 가능한 혈액 정화 장치의 한계와 향후 사용 가능성을 보여주고, 표 2는 자연 신장 기능과 비교하여 혈액 정화 장치의 한계를 보여줍니다.
표 1. 제한 사항이 있는 사용 가능한 혈액 정화 장치 및 iBAK에서 향후 사용 가능
표 2. 사용 가능한 혈액 정화 장치는 자연적인 신장 기능에 비해 한계가 있습니다.
- 요약
신장은 지금까지 확산과 대류를 통해 좁은 스펙트럼의 분자를 제거하는 것을 목표로 하는 체외 정화 기술로 대체되어 온 수많은 복잡한 기능으로 구성되어 있습니다. 대사(특정 분자의 재흡수 및 분비) 및 내분비 기능은 아직까지 이용 가능한 정제 기술에 의해 구체적이고 완전하게 재현되지 않았습니다.
또는 임상적 사용. 신장 세포 치료를 위한 이식형 생물반응기의 타당성은 면역학적 분리, 세포 생존 가능성 및 대사 활동을 위한 혈액 기질 유지 가능성을 보장하는 실리콘 나노기공 막 기반의 완전히 이식 가능한 생체 인공 신장(iBAK)을 개발하는 과제를 열어줍니다. 복잡한 장치에서 신세뇨관 세포를 장기간 생존시키기 위한 특정 기술의 개발은 인공 신장의 대사 및 이화작용 기능을 달성하기 위한 기초를 형성하므로 특히 중요합니다. 개별 신장 기능(여과, 분자 확산, 물과 용질의 재흡수, 약물의 내분비 및 이화 작용, 면역 조절) 관리를 위한 별도의 모듈을 가질 수 있는 가능성은 미래에 복잡하고 이식 가능한 장치를 구축하는 것을 가능하게 할 것입니다. 평생 동안 지속적인 침습적 유지 관리 없이도 환자 치료가 가능합니다. 미래의 과제는 개별 모듈을 소형화하고 이를 ESKD 환자에게 이식할 수 있는 복잡한 장치에 통합하는 동시에 허용 가능한 수명을 보장하는 것입니다.
iBAK의 복잡성으로 인해 FDA, EMA, EU 인증 기관과 같은 규제 기관과 표준 발행 기관의 지원을 받아 다양한 분야의 노력이 필요합니다.
The Future for End-Stage Kidney Disease Treatment: Implantable Bioartificial Kidney Challenge
Department of Medicine, Nephrology-Dialysis-Kidney Transplant Unit, University of Padua, 35128 Padua, ItalyDepartment of Cardiac Thoracic Vascular Sciences and Public Health, Unit of Biostatistics, Epidemiology and Public Health, University of Padova, 35128 Padova, ItalyASL VCO, 28922 Verbania, ItalyDepartment of Surgical Oncological and Gastroenterological Sciences, Kidney and Pancreas Transplant Unit, University of Padua, 35128 Padua, Italy
Author to whom correspondence should be addressed.
These authors contributed equally to this work.
Appl. Sci. 2024, 14(2), 491; https://doi.org/10.3390/app1402049
Abstract
Despite limited organ availability and post-transplant complications, kidney transplantation remains the optimal treatment for End-Stage Kidney Disease (ESKD). However, innovative dialysis technologies such as portable, wearable, and implantable bioartificial kidney systems are being developed with the aim of addressing these issues and improving patient care. An ideal implantable device could combine bioreactors and blood ultrafiltration to replicate key native cell functions for solute reabsorption, secretion, and endocrinologic activities. Today, the feasibility of an implantable bioreactor for renal cell therapy opens the challenge of developing a fully implantable bioartificial kidney based on silicon nanopore membranes to ensure immunological isolation, cell viability, and the possibility of maintaining a blood substrate for metabolic activities. Current technology is not sufficient to obtain an efficient artificial bioreactor to reach physiological blood purification, which requires a more complex system to produce an ultrafiltrate from the blood that can be processed by cells and eliminated as urine. The number of cells in the bioreactor, endocrine activity, immunological cell isolation, solute and fluid secretion/reabsorption, cell viability, blood and ultrafiltration flow control, and thrombogenicity are fundamental issues that require a new technology that today appears to be a challenge for the design of an implantable artificial kidney. This review aims to analyze the state of the art in this particular field of kidney replacement therapy to highlight the current limitations and possible future technology developments to create implanted and wearable organs capable of treating ESKD with artificial organs that can replicate all native kidneys functions.
Keywords:
end-stage renal disease; chronic kidney disease; kidney transplant; implantable bioartificial kidney; bioreactor
1. Introduction
End-Stage Kidney Disease (ESKD) represents the final, irreversible stage of chronic kidney disease, where the kidneys lose their ability to sustain the essential life-supporting functions due to significant and permanent damage. At this stage, kidney replacement therapies become essential for survival. The primary modalities of treatment include dialysis and kidney transplantation. Dialysis, which can be performed as either hemodialysis or peritoneal dialysis, involves mechanically removing waste products and excess fluid from the blood when the kidneys can no longer perform these tasks. Hemodialysis is typically performed in a clinic setting several times a week (usually three times per week), while peritoneal dialysis can be performed at home but requires daily treatment. Kidney transplantation, on the other hand, involves the surgical replacement of the kidney function with a healthy kidney from a donor, living or deceased. Transplantation generally offers better quality of life and survival rates compared to dialysis but requires immunosuppressive medications to prevent organ rejection. Each of these therapies has its indications, advantages, and limitations, and the choice of therapy is individualized based on patient-specific factors including the underlying cause of ESKD, patient’s overall health, lifestyle considerations, and personal preferences. This article reviews the state of the art of existing technologies for replacing the kidney function through the use of wearable and implanted artificial organs by analyzing their current limitations and possible future developments.
1.1. The End-Stage Kidney Disease and the History of Kidney Replacement Therapy
The total number of patients affected by End-Stage Kidney Disease (ESKD) saved by the artificial kidney can hardly be estimated, but it is surely very high. The history of dialysis technology evolution has one of its milestones in 1943, as the first practical dialyzer composed of a 20 m long rotating cellophane tube wrapped around a 2 m horizontal drum serving as a semipermeable membrane was realized by a Dutch physician, Doctor Willem Kolff [1]. The major limitation of this device, without considering the large extracorporeal volume required, was inappropriate body fluid removal, which is one of the most important issues during fluid overload in renal dysfunction. In fact, in this system, gravitation generates a transmembrane pressure that was not adequate to effectively achieve ultrafiltration as required by the patient’s clinical status. Therefore, conditions characterized by fluid overloads, such as pulmonary edema or hypertension, could not be effectively treated by this device.
The opening success of this prototype was followed by the implementation of a modified dialyzer that was enabled to bear higher transmembrane pressure to ensure fluid removal [2]. Subsequent development of precise ultrafiltration control systems using scales and flow control have made fluid removal precise and safe making the fluid balance control an achievable and customizable clinical goal for each individual clinical setting. As the very first chronic dialysis facility was founded in Seattle in 1960, renal failure was no longer a fatal disease.
1.2. Current Extracorporeal Purification between Limitations and New Perspectives
Current hemodialysis techniques include hollow-fibered dialyzers that replaced the original giant rotating drum kidney and represent today essential therapeutical options for patients admitted to hospitals with acute kidney injury (AKI) or ESKD. Although these devices have been shown to extend the lives of patients, the existing blood purification technology is still not perfect, being based only on processes of removing molecules from the patient’s blood.
New technology is needed to overcome the shortcomings represented by the patient’s quality of life, intra-hemodialysis issues, and the still unmatched replacement of kidney metabolic functions. Although the available blood depuration system has improved in terms of effectiveness, efficiency, and biocompatibility, the principles of blood purification have not changed from the first generation of artificial kidneys. From this point of view, the main targets of dialyzers are solute clearance and fluid removal from the patient without providing molecule reabsorption, catabolism, and endocrine function which are active functions that can be performed by a more complex system than the dialysis filter. Bioengineering has developed a specific blood purification technology to achieve the removal of molecules retained during ESKD based on the specific dialyzer structure, performance, biocompatibility, and membrane material. Thus, research in this area is directed toward finding devices that are increasingly efficient in removing target molecules but without finding viable solutions in the area of reabsorption and secretion of specific molecules. Artificial kidneys and semipermeable membranes for blood purification are still a current matter of research. Due precisely to their future characteristic of being bioartificial, artificial kidneys could significantly implement extracorporeal purification by introducing the activities of secretion, reabsorption, and metabolic activity. The advances in synthetic membranes, nanotechnology, and experience in dialysis have contributed to the potential of forthcoming dialyzer development; in fact, it took decades to develop the system of blood purification currently in use. Nowadays, such development allowed the move from regular dialysis for ESKD to Continuous Kidney Replacement Therapy (CKRT) in the Intensive Care Unit (ICU). The ability to have advanced and safe software and hardware to perform CKRT allows us replacement of renal function in a continuous way especially in highly critical and unstable patients that require continuous adjustment of renal metabolic compensation to their clinical needs. Despite these technological implementations, a lot of work is still to be conducted in order to improve the three major drawbacks of current hemodialysis techniques: patients’ quality of life, technical problems that may occur during dialysis treatment, and the impossibility of replacing the kidney’s metabolic functions [3].
The most important aspect that should lead the development of the new generation of artificial organs is that natural kidneys are not mere organs of filtration. As a matter of fact, they are also in charge of several metabolic functions, such as the synthesis of 1,25-dihydroxyvitamin D (1,25(OH)2 D) [4], ammonia genesis [5,6], glutathione metabolism [7], erythropoietin production [8], and immunoregulatory support [9]. Thus, to truly fulfill every kidney function, the renal metabolic role is to be taken into consideration. In fact, modern designs of artificial kidneys put much emphasis on the efficiency of dialysis and fluid removal but not on its metabolic functions. From a clinical point of view, this lack of metabolic activity requires the use of specific drugs that must be administered to the patient according to a biochemical feedback that has to be regularly checked with blood tests. Therapeutic adjustments are therefore subject to a constant delay due to the inability to have continuous online feedback as is the case with the metabolic activities of the natural kidney. Typical examples are changes in the dose and frequency of erythropietin administration to maintain a constant hemoglobin in the patient, or the administration of vitamin D analogs to maintain proper bone metabolism. At present, the most effective approach to replacing organ function is the utilization of transplanted organs. Despite the limited organ availability and possible post-transplant complications, kidney transplantation remains the optimal treatment for ESKD. On the other hand, dialysis—both extracorporeal and peritoneal—is only life-sustaining and provides limited removal of uremic toxins. Despite the advances in technology, hemodialysis (HD) is still expensive, burdened by higher mortality, vascular access complications, and lesser quality of life and patient satisfaction compared with peritoneal dialysis, which, however, presents lower efficacy and a high risk of infections, which are the primary reason for transfer to HD [10]. Home hemodialysis (HHD) is believed to be more physiological and better tolerated by patients than in-center hemodialysis. Moreover, it has a number of advantages, including improved survival and quality of life (QOL), flexibility, and potential for employment compared to in-center hemodialysis [11,12,13,14]. Technological research has moved towards the improvement and miniaturization of home hemodialysis services in order to overcome the constraints of standard HD with the development of new purification devices, such as novel dialyzers that mimic active processes of ultrafiltration and secretion in the native kidneys [15], membranes, wearable technology and sorbents for regenerating dialysate. These advances represent the first step towards the development of implanted devices capable of fully replacing natural renal function.
The miniaturization of hemodialysis machines requires the development of advanced technologies that involve a multidisciplinary effort, including multiple clinical and technical elements such as vascular access, blood flow in the circuit, purification techniques, and catabolic and synthetic activity. Considering that at least 120 L of dialysate is required in a hemodialysis treatment, the regeneration of the waste fluid is necessary in order to allow the system downscaling into a portable device. The aim is to provide the elimination of substances through chemical breakdown and ion exchange [16,17] or adsorptions to maintain electrolyte concentration within the normal range. Commonly, prolonged treatments, especially CKRT, can clinically result in excessive removals of ions that require their external supplementation as is the case for phosphate and potassium. This is reflected in an overload of work for nurses and a need for customization of treatments in terms of prescription, type of fluids used, and prescribed depurative dose. In a wearable/implantable device, this issue should be solved by intrinsic solutions in the device used minimizing external interventions by the physician, nurse, and patient. Specific devices can have an important role in this field not only to remove substances from dialysate, but also to exchange ions. The sorbent most commonly considered for this purpose is activated carbon. Historically, activated carbon was used in a home dialysis system that recirculated a 6 L batch of dialysate. Currently, the processing of spent dialysate by activated carbon (AC) is being considered to reduce the dialysate requirement for both hemodialysis and peritoneal dialysis. However, there is remarkably little research into the ability of activated carbon to remove different uremic solutes [18], in particular urea, that, in contrast to other organic waste compounds, binds poorly to sorbents (affinity for AC∼0.1 mmol/g). In addition, its amount is consistent, ranging from 240 to 470 mmol/day, making it the primary nitrogenous waste product of the metabolism [19]. The need to tailor the purifying dose to the individual metabolic needs of the patient plays an important role and represents a challenge for new implantable devices. According to the technology available for wearable miniaturized devices, urea removal can be obtained by the use of urease-catalyzed hydrolysis into bicarbonate and ammonium, which is more toxic than urea. In this case, zirconium phosphate may be used to remove ammonium by the dialysate; the bicarbonate released by hydrolysis, instead, reacts with protons to generate water and carbon dioxide, effectively removed from the dialysate closed-loop system [20]. Urea removal at the rate of 16 mmol/h is also possible, taking advantage of its electrochemical decomposition into N2 and CO2, which can be outgassed from the dialysate by using a device with reusable graphite electrodes [21]. Cartridge uptake could be another solution to urea removal in an effective, simple, and safe way. Sorbents can remove urea from dialysate either by forming covalent or coordination bonds (chemisorption) or by non-covalent bonds (van der Waals forces, dipole interactions, and hydrogen bonds, i.e., physisorption). However, in physisorption, even if the process is faster, the resulting bonds are weaker with sorbent-bound urea in equilibrium with urea dissolved in the dialysate, resulting in a lower removal efficiency [22]. Recent developments have shown the potential of sorbents for the effective removal of urea from the dialysate, among which are silicon dioxides (silica) and zeolites; however, aluminum leaching from zeolites is a potential hazard for the patient. All these solutions, although very interesting and fascinating from a technical point of view, still pose a whole series of limitations that make their use strictly experimental in prototypes that are unlikely to evolve into implanted and indomitable purification systems in the near future, although the wearable artificial kidney (WAK) could be a very promising way to provide a practical solution to the needs of patients. However, at present, only a few technical proposals have tried and are trying to achieve a realization of the WAK system to be used in clinical practice [15]. Gura et al. demonstrated that treatment with the wearable artificial kidney was well tolerated, resulting in the maintenance of electrolyte and fluid homeostasis with effective uremic solute clearance. However, of the seven enrolled subjects, only five completed the planned 24 h treatment study. In fact, the trial was stopped because of device-related technical problems, such as excessive carbon dioxide bubbles in the dialysate circuit [16]. One of the most critical elements for extracorporeal purification in wearable devices is the ability to regenerate dialysate for long periods. Sorbent-based dialysate regeneration system has been effectively applied to the treatment of acute and chronic kidney failure patients for many years, and now it seems to have great potential in this research field. However, there are issues associated with the use of sorbents and resins to maintain the pH and electrolytic composition of the dialysate in the range required by the patient’s clinical condition. In their preliminary report, Gura et al. [16] demonstrated that patients tolerated this treatment very well and were allowed eating and drinking, as about 1 L of water was removed by ultrafiltration, with no significant change in blood pressure. Moreover, they demonstrated patient feedback in terms of a lack of interdialytic symptoms and a minimal to zero recovery time post treatment; patients were equally positive in their perception of the therapeutic potential of this device in terms of facilitating treatment flexibility, freedom, and improved lifestyle. The clinical subjective impact of such technology appears to be positive, with patients’ perception that the system is safe and easy to use in daily life. These findings confirm that by redesigning to address the identified technical issues, a wearable artificial kidney can be successfully created as an innovative and feasible alternative to traditional dialysis technology. An ideal implantable bioartificial kidney could overcome the problem of dialysate regeneration by mimicking the full renal function. This could be achieved by combining bioreactors and blood ultrafiltration to replicate key native cell functions for solute reabsorption, secretion, and endocrinologic activities (1,25-OH-vitamin D and erythropoietin production). In order to mimic the complex renal functions and to achieve fluid balance and waste removal [23] by filtration and secretion, the implantable bioreactor needs to be combined with an ultrafiltration system. This ensures the reabsorption of useful molecules such as bicarbonate, amino acids, glucose, and phosphate.
In the context of nephrology, and specifically in the field of extracorporeal blood purification, a bioreactor can be defined as a specialized device designed to support the growth, maintenance, and function of renal cells or tissues in a controlled environment to mimic the physiological kidney function to provide a platform for blood purification to improve dialysis technology development with metabolic and molecule reabsorption and secretion activities.
In a nutshell, the future of artificial kidneys aims at miniaturization and implantability, better biocompatibility, and metabolic function combining all available technology. It is undoubted that membranes are the fulcrum of extracorporeal treatment, and technological advances in membrane design, chemical composition, and sterilization methods lead to enhanced performance with the reduction of dialysis “unphysiology”. Modifications of the composition of HD membranes have improved their biocompatibility and improved patient quality of life. Specifically, membranes composed of polymeric or inorganic material appear to be more efficient for the removal of uremic toxins compared to synthetic membranes. However, membranes utilized for hemodialysis are efficient in the removal of small water-soluble solutes and toxins, but their efficiency decreases proportionally for middle to large molecules and toxins. Protein-bound uremic toxins are also hard to remove. Ideally, membranes have to mimic glomerular filtration [24] with molecular weight cut-offs up to ~66 kDa [25]. The prolonged use of these membranes, while mimicking the continuous kidney filtration, leads to issues such as biocompatibility and filter patency, becoming a further challenge for the development of implantable devices. In order to implement biological functions and purification efficacy, the novel membranes could be combined with bioartificial kidneys, where artificial membranes are combined with kidney cells in bioreactors. To overcome the shortcomings of current devices for artificial kidneys, studies and trials of silicon nanopore membranes, tissue engineering for renal cell bioreactors, and dialysate regeneration are under development. With future advancements, wearable or implantable artificial kidneys will be soon achievable [26]. The feasibility of an implantable bioreactor for renal cell therapy was demonstrated by Kim et al. [27], opening the challenge to the development of a completely implantable bio-artificial kidney (iBAK). Such a device is based on silicon nanopore membranes that ensure immunological isolation, cell viability, and the possibility of maintaining a blood substrate for metabolic activities.
Research in the field of membranes is developing new materials to overcome the limitation of blood purification in wearable and implanted devices due to the actual structural limitation of classical dialyzers. The new synthetic dialysis membranes are composed of hydrophobic polymers blended with Polyvinylpyrrolidone (PVP) or other additives to improve biocompatibility, although the long-term use and sterilization process can elute them, reducing compatibility [28,29]. To resolve this problem, polyvinylidene fluoride membranes are coated with polyvinyl alcohol and chitosan. This improves biocompatibility [30] and can determine white cells, complement activation, and filter clotting. The issue of filter clotting can be reduced by using membranes with grafted argatroban onto the surface of polysulfone membrane [31], achieving a good anti-thrombogenic effect. Despite all these implementations, the potential miniaturization of this new type of membrane is limited [32] due to permeability limitations caused by fiber geometry and hydraulic resistance, which requires bulky devices. Another membrane limitation is its relatively broad pore size distribution that limits filtration selectivity, which is now overcome by silicon-based nanoporous membranes (SNMs) presenting uniform nanopores with a deviation between pore sizes of less than 1% [32,33,34]. In order to enhance permeability due to their low porosity, these SNMs have been fabricated with arrays of nanoslits (10 nm wide and 4.5 μm long) [34], presenting uniform nanopores suitable for hemodialysis and hemofiltration. Their limitation in clinical use concerns the poor silicon hemocompatibility, which requires a hydrophilic coating with polyethylene glycol (PEG) to prevent activation of macrophages, innate immunity dysregulation, and inflammation. This technological solution is not definitive [34], as in an implantable artificial kidney, the PEG can quickly degrade, so much longer-lasting alternatives are needed. The combination of a hemocompatibility inner porous layer based on polyethersulfone/polyvinylpyrrolidone (PES/PVP) and an outer layer of activated carbon dispersed within a matrix of PES/PVP in contact with the dialysate can determine low cell adhesion with improved hemocompatibility, associated with enhanced toxin removal by diffusion/convection and inner membrane layer adsorption by activated carbon particles, which leads to a high toxin concentration gradient across the membrane, thus stimulating the further dissociation of protein-bound toxins from plasmatic proteins. This process can enable the application of lower amounts of dialysate than conventional hemodialysis membranes. Additionally, this membrane structure can protect the patient from bacterial pyrogen contamination from the dialysate [35]. It seems that the development of such membranes introduces important advantages for implantable systems, where a low quantity of dialysate is required for prolonged application. The permanence of such implanted devices for a prolonged period could result in the deterioration of dialysate characteristics, including bacterial contamination, and any form of patient protection could be helpful. To mimic the glomerular filtration, the characteristics of current membranes had to be implemented in the WAK, and the system supplied with a closed-loop dialysate regeneration system. Otherwise, to mimic the tubular reabsorption of water, ions, glucose, and amino acids from the filtrate, it is necessary to imply a specific technology based on ion exchange resin combination, ion exchange membranes, and an externally applied voltage to achieve selective ion reabsorption.
1.3. Bioreactors for Artificial Kidneys
Bioreactors may in the future provide metabolic support to the filtration and absorption activities determined by current dialysis filters. Combined plasmatic water filtration systems and ultrafiltrate and blood reprocessing devices are the basis of more complex devices directed at blood purification (Figure 1). The use of cultured proximal cells on artificial membranes in the implantable Bioartificial Kidney (iBAK) aims at mimicking proximal tubule function. However, cell source availability, distribution, storage, and the following reconstruction represent a challenge. The chance to design an experimental bioartificial renal epithelial cell system in niobium-coated carbon disks covered with renal epithelial cells from adult progenitor kidney cells discloses the possibility of cryopreserve and cryostorage this device so that it can be carried and thawed at the end-use location [36]. The combination of immortalized proximal tubule epithelial cells on functionalized hollow fibers with conventional hemodialysis filters makes this technology able to mimic glomerular filtration, tubular secretion, and reabsorption, thus allowing the most “physiologic” and complete replacement of kidney functions [37,38]. The availability of such technology has enabled the realization of an animal iBAK prototype consisting of an SNM hemofilter with sub-10 nm wide slit pores in series with a porcine renal cell (LL-CPK1) bioreactor unit cultured on as SNM.
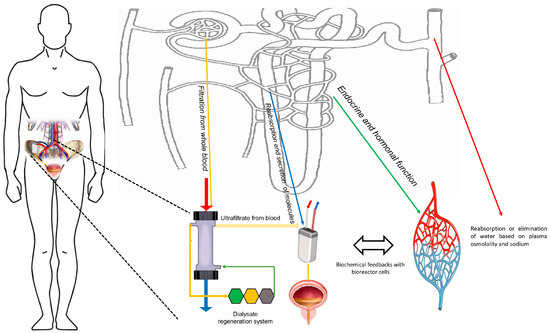
Figure 1. iBAK and nephron, integration of nephron activities into a modular and complex device. In red, blood entering the device; in blue, blood leaving the device. In yellow, the dialysate and ultrafiltrate processed by the filter and bioreactor. The functions of filtration, reabsorption from the ultrafiltrate, secretion into the ultrafiltrate, regeneration of the dialysate, production of hormones, and modulation of water reabsorption/excretion are handled by different devices combined with the bioreactor in a more complex device.
Currently, the only device with relevant clinical results for the future development of an iBAK appears to be the WAK designed by Gura [16,39]. The WAK has been tested only in three small clinical trials so far in two different hemodialysis duration regimens, shorter (up to eight hours) and longer (24 h), respectively. Ultrafiltration and clearances of urea, creatinine, and phosphorus have been revealed to be effective. The major criticalities of this system concern the formation of bubbles, coagulation of the filter and lines, and the need for continuous treatment in order to achieve an effective and clinically relevant middle molecule clearance in a diffusive modality. The combination of diffusion and convection can increase purification efficiency, but in wearable and implanted devices, it is limited by the low volumes of dialysate and the inability to regenerate ultrafiltrate. This problem may be partially overcome by the implementation of a “push–pull” pump, a process that produces an alternating transmembrane pressure with a small volume of dialysate back and forth across the dialyzer, thus generating a convective force that improves middle molecule clearance. The integration of this system with microvalves and standard silicon and microelectronics technology would allow the opening and closing of fluidic channels and fluid pumping, rendering it available for wearable devices [40].
2. Future Perspective beyond Current Technical Limitations
It is evident that the current technology was developed to overcome individual technical problems [41] but did not lead to real integrations in the artificial kidney development, as modern devices cannot mimic all kidney functions. The experimental results obtained so far have opened up the future for the design of prototypes to be used in clinical trials. Individually, these experimental achievements are not enough to obtain an efficient artificial bioreactor to reach physiological blood purification. To reach this objective, a new type of implantable iBAK is necessary. The iBAK may be inserted into a more complex system able to provide a ultrafiltrate from the blood to be processed by cells and eliminated as “artificial urine” through a stoma or bladder. At the same time, the contact between blood and the bioreactor should be able to provide nutritional substrates to renal cells and guarantee their endocrine activity (Figure 1). While the use of silicon nanopore membranes looks very promising for the realization of a future iBAK [27], some technical aspects appear to limit its use. The number of renal cells in the bioreactor (1.2 × 107 cells vs. 5 × 109 proximal tubular cells in a human kidney) [42], compared to a physiological nephron mass, is too low to guarantee physiological solute secretion, reabsorption, and hormone production. Immunological isolation may no longer be effective as the number of cells increases, exposing them to damage and death. Cell viability could be limited in time, clearly opening the problem of a faster frequency of cell replacement in the bioreactor, which is not ideal for an implantable device whose functioning should last for several months. Another key point is the control of the blood flow and the regulation of ultrafiltration for fluid removal. Indeed, the blood flow in the iBAK should be based on the arteriovenous gradient with safe flow-pressure feedback to ensure continuous bioreactor perfusion, maintaining stable fluid ultrafiltration for continuous artificial urine production. Such a control mechanism also requires an engineering challenge in terms of fluid removal, which should rely on patient hematocrit and blood protein levels to maintain the patient euvolemic state. In the event of patient hypovolemia, fluid reabsorption from the artificial urine is a major engineering challenge. This is due to its physical and biochemical complexity in terms of simultaneous reabsorption of sodium and water in relation to plasma osmolality [43]. This issue requires the use of advanced technology that allows the regulation of plasma osmolarity with complex feedback, including algorithms for the management of ultrafiltration [44], blood flow, and fluid reabsorption or elimination. The synergy of these ultrafiltration mechanisms becomes essential in anuric patients in whom a correct fluid balance is essential to avoid hypervolemia and its complications, such as acute pulmonary edema. On the other hand, the ability to concentrate on the device becomes essential in patients with preserved diuresis in order to avoid states of dehydration. The lack of bioreactor ability to regenerate bicarbonates and eliminate hydrogen ions could have repercussions on the maintenance of the acid–base balance. Likewise, the lack of feedback for aldosterone could indicate a deficiency in potassium secretion and sodium reabsorption, while the lack of ADH target cells could lead to clinically significant variations in plasma osmolality. All such activities cannot be recreated through bioreactors containing a single cell line, requiring different cell types for these specific functions. Concentrating multiple cell lines in a single bioreactor is currently unthinkable. This is due to the different interactions between blood and ultrafiltrate depending on the specific functions that must be performed. An additional problem comes from the thrombogenicity of the device, which may be overcome by using extremely biocompatible materials to minimize the thrombogenic effect of blood contact. Furthermore, in the quest for miniaturization for implantability, the geometry of the ultrafiltration device must provide an adequate and uniform distribution of the blood flow for an ideal ultrafiltration profile [45]. This configuration allows maximization of the blood flow, obtaining the best ultrafiltration in relation to the utmost miniaturized filtering surface to guarantee its implantability. Wearable ultrafiltration devices (WUF) and WAK have already been tested in humans [46] with encouraging clinical results. However, their technical limitations have discouraged their further development; such barriers concern the vascular access provided by a Central Venous Catheter (CVC), the need for systemic anticoagulation, the weight of the device (1.1 Kg), its wearable and non-implantable nature, and the low battery life [47]. All the above restraints may be solved with innovations in the field of artificial kidneys through the utilization of new disciplines such as nanotechnology, materials physics, materials engineering, miniaturization, and microfluidics [48], leading to a new era of dialysis in which the new challenge is the development of the iBAK that could eventually save millions of lives [49].
The technological process of transition from in-center to home hemodialysis requires the miniaturization of devices and the introduction of technological innovations that enable their progressive use toward wearability. Current technology is limited, as hemodialysis therapy removes a limited range of uremic toxin discontinuously and requires large volumes of dialysate, thus limiting the portability and patient quality of life and autonomy. The first issue to be addressed concerns the reduced volume of dialysate needed and its regeneration in wearable and implanted devices. The use of different types of sorbents for this purpose has an impact on the ecological footprint of sorbent production and recycling. The reduced removal of uremic toxins resulting from the reduced volume of dialysate in wearable/implanted devices is compensated for by the use of polymeric or inorganic materials in novel dialysis membranes. Such innovative membranes can improve the removal of a broad range of molecules by filtration and adsorption, thus ensuring high efficiency and low levels of membrane fouling compared with currently available membranes for classical hemodialysis. The function of seemingly simplistic uremic toxin removal has to be coupled with biological functions to replace every function of the kidney, such as the production of erythropoietin and vitamin D. This requires the combination of artificial kidneys with bioreactors able to ensure not only the production of hormones but also the catabolism of drugs and the reabsorption of useful molecules from the ultrafiltrate processed in the system (Figure 1). In this way, the physical diffusive and convective processes can be exploited to the fullest to achieve a purification target that maintains the metabolic balance in the patient without leading to the loss of useful molecules in the purification process. In this scenario, the synthetic metabolic demand and the reabsorption process have to be ensured by the use of kidney cells capable of surviving and maintaining metabolic functions for long periods while reducing maintenance interventions on the device. The biggest problem concerns the kidney cell source, their culture facilities attached to dialysis centers, and finally the large-scale low cost. The complexity of such a system raises a number of issues concerning manufacturing, feasibility, and logistics. A complex implantable artificial kidney would have much lower blood flow resistance than an extracorporeal device. Using natural blood pressure as a driving force would avoid the need for an artificial blood pump and reduce the energy supply requirements. This configuration can be achieved by the connection of iliac vessels, but anastomosis, blood compatibility, and surface thrombogenicity can represent critical issues of implanted devices. To overcome these problems, heparin-coated surfaces can be used even though their stability, in the long run, is not optimal, and alternative solutions with polyethylene glycol have limited effects. Certainly, vascular access becomes a key topic for implanted devices that have to be maintained in place for months/years. These vascular accesses have to ensure easy and rapid replacement of attached devices, adequate blood flow, and reduced risk of clotting even during relative hypotension or hypovolemia due to concomitant acute and chronic diseases. A promising solution is the coating of silicon membranes with sulfobetaines [50]. The implanted device requires a balance between dimension and membrane surface to guarantee the filtration and the possibility of increasing the number of renal cells in the bioreactor in order to provide physiological solute secretion, reabsorption, and hormone production. If this device were to be implanted with invasive surgery, it would require a product safety level and mean time between failure and lifetime like that of a Ventricular Assistance Device in order to make the patient not dependent on continuous maintenance interventions or surgery.
Finally, the complexity of renal physiology requires the development of a composite iBAK, which should be the result of the collaboration of multiple disciplines for the development of a technology to artificially reproduce all kidney functions. The possibility of introducing complex iBAKs could allow the development of distinct modular devices the replacement of every single renal function (ultrafiltration, hormone production, reabsorption, molecule secretion, metabolism, fluid balance, etc.). The integration and progressive miniaturization [51] of these modules will allow the development of devices the ability to replace renal functions more effectively than current therapeutic options, which focus on solving individual problems rather than integrating functions. The chance to adopt a modular device composed of individual units will also empower better maintenance management of the device by making it possible to replace or repair a single part instead of the entire device. The real challenge of the future to guarantee the replacement of renal function through an artificial organ, therefore, lies in the development of a complex iBAK or artificial transplantable kidneys from organoids [52,53]. Table 1 shows the available blood purification devices with their limitations and possible future uses in iBAK, while Table 2 shows the limitations of blood purification devices compared to natural kidney functions.
Table 1. Available blood purification devices with their limitations and possible future use in iBAK.

Table 2. Available blood purification devices have their limitations compared to natural kidney functions.

3. Summary
The kidney comprises numerous complex functions that, until now, have been replaced by extracorporeal purification techniques aimed at removing a narrow spectrum of molecules through diffusion and convection. Metabolic (reabsorption and secretion of specific molecules) and endocrine functions have not yet been specifically and completely reproduced by the purification techniques available for clinical use. The feasibility of implantable bioreactors for renal cell therapy opens the challenge of developing a completely implantable bio-artificial kidney (iBAK) based on silicon nanopore membranes that ensure immunological isolation, cell viability, and the possibility of maintaining a blood substrate for metabolic activities. The development of specific technologies for keeping renal tubular cells alive for long periods in complex devices is of particular interest, as it forms the basis for achieving the metabolic and catabolic functions of artificial kidneys. The possibility of having separate modules for the management of individual kidney functions (filtration, molecules diffusion, reabsorption of water and solutes, endocrine and catabolic activity of drugs, and immunomodulation) will make it possible in the future to build complex, implantable devices, the lifetime of which will allow patient treatment without the need for continuous invasive maintenance. The challenge for the future is to miniaturize the individual modules and integrate them into complex devices that can be implanted in patients with ESKD while ensuring acceptable lifetime.
The complexity of iBAKs requires a multidisciplinary effort with the support of regulatory agencies such as the FDA, the EMA, and EU-notified bodies, as well as standards-issuing organizations, to promote innovation and expedite access to the new technology in this field.










